近日,来自美国纪念斯隆凯特琳癌症中心的Piro Lito团队在Science杂志上发表了一篇题为 The G protein signaling regulator RGS3 enhances the GTPase activity of KRAS 的文章,这项研究报道了RGS3,一种先前已知的用于调节G蛋白偶联受体的GAP,可以以不依赖于传统催化精氨酸残基的方式同时增强突变型和野生型KRAS蛋白的GTPase活性,这种新发现的调控机制对于理解和治疗靶向KRAS蛋白驱动的癌症具有重要意义。

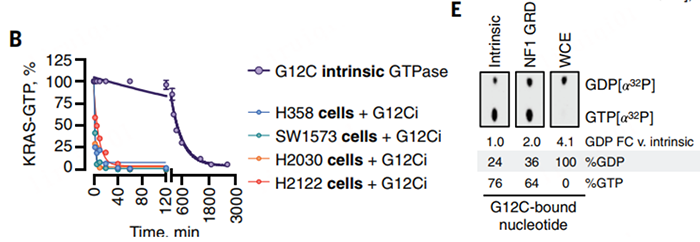
该团队首先发现,使用多种不同G12C抑制剂(G12Ci)处理血清剥夺(核苷酸抑制条件)的细胞,最大程度抑制KRAS(即减少KRAS-GTP结合状态)所需的时间明显短于处理含10%血清的细胞以及体外纯化的条件,表明存在某种通过KRASG12C增强GTP水解的细胞因子。如果将KRASG12C、GTP[α32P]与细胞提取物孵育,与NF1的GAP相关域孵育的KRASG12C结合的主要是[α32P]标记的GTP,而与肺癌模型细胞提取物孵育的KRASG12C结合的主要是[α32P]标记的GDP,进一步说明可以增强KRASG12C的GTPase活性的细胞因子的存在(图1)。
‘
图1. 癌细胞提取物中存在某种可以增强KRASG12C水解能力的物质
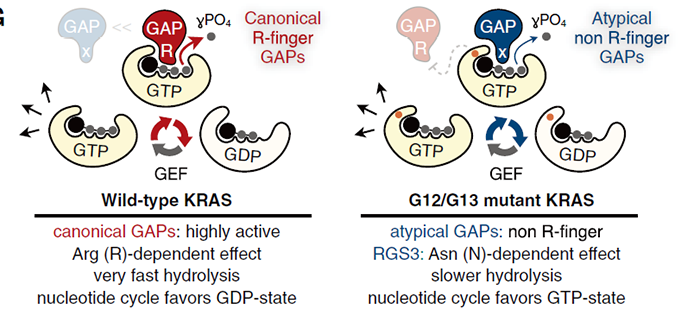
为了分离这种蛋白,该团队设计一种纯化方案并分析每个色谱步骤的洗脱级分的光密度和增强KRASG12C水解的能力。其中,RGS3是异源三聚体G蛋白偶联受体的Gαi/q亚基的GAP,但缺乏经典的RAS-GAP中存在的催化精氨酸(R)残基,由此可以推断RGS3可能不受G12突变的影响,并决定进一步对此进行研究。首先,三个不同细胞系中的免疫共沉淀表明RGS3与KRASG12C存在相互作用,且会在G12Ci的处理后减弱。通过体外磷酸盐测定实验,该团队确认RGS3可以增强KRASG12C的GTP水解能力,且不依赖于传统意义上RAS-GAP的精氨酸残基。基于晶体结构构建的分子模型提示,可能是RGS3的GAP结构域中的天冬酰胺(N)残基发挥作用,这一残基在RGS同种型之间是保守的,说明该家族的其他成员也具备增强KRAS突变体的GTPase活性。如果沉默KRASG12C肺癌细胞中的RGS3,则会引起KRAS激活增加,异种移植模型中肿瘤增殖加速。
那么是否可以推断,RGS3的表达可能与KRAS的激活呈负相关呢?与此猜想一致,该团队发现携带KRAS突变的肺癌患者中,较高的RGS3表达与较低的KRAS突变体的信号输出相关,且具有高RGS3表达水平的肿瘤具有更大程度的抑制。此外,RGS3-/-细胞中KRASG12C对GTP[ɣ32P]水解的能力明显减弱,若补充RGS3则可以恢复水解能力,而补充RGS3N460H则不会恢复该能力。
总的来说,这项研究报道了KRAS的GTPase活性可以被非精氨酸残基依赖性的方式增强,几种KRAS致癌突变体的GTP水解能力取决于RGS3的GAP结构域中的关键天冬酰胺残基,这种非经典的调控机制对于靶向治疗KRAS突变驱动的癌症非常重要。

针对这项研究,来自美国北卡罗来纳大学教堂山分校的Adrienne D. Cox和Channing J. Der在同期杂志上发表了观点:Filling in the GAPs in understanding RAS。他们认为这项研究解释了先前存在的悖论,即为什么KRASG12C在对经典GAPs不敏感的同时还会存在足够的GDP-KRASG12C使其易受KRASG12C抑制剂的影响,确认RGS3作为KRASG12C的弱激活GAP,对于KRASG12C抑制剂的临床应用具有重要意义,举例而言,一部分携带KRASG12C的非小细胞肺癌对 KRASG12C抑制剂具有从头耐药性,而这项工作指出RGS3的表达水平与患者来源的肺癌异种移植模型中对KRASG12C抑制剂的敏感性相关。因此,RGS3可以作为一种生物标志物来识别对这些抑制剂最敏感的患者,RGS3模拟物或许也可以作为有效的KRAS突变体抑制剂。













